BAB 23
LOGAM TRANSISI DAN SENYAWA KOORDINASI
1. Tujuan[Kembali]
a. Mampu
memahami tentang logam transisi
b. Mampu
memahami tentang senyawa koordinasi
2. Alat dan Bahan[Kembali]
· Alat:
a. Tabung reaksi
Tabung reaksi, adalah peralatan gelas yang umum ada di laboratorium berbentuk tabung sebesar kira-kira jari tangan manusia dewasa, terbuat dari kaca atau plastik, terbuka di bagian atasnya, biasanya alasnya berbentuk huruf-U.
b. Gelas ukur
Gelas ukur adalah peralatan laboratorium umum yang digunakan untuk mengukur volume cairan. Alat ini memiliki bentuk silinder dan setiap garis penanda pada gelas ukur mewakili jumlah cairan yang telah terukur.
· Bahan:
a. Besi
Besi adalah unsur kimia dengan simbol Fe (dari bahasa Latin: ferrum) dan nomor atom 26. Merupakan logam dalam deret transisi pertama. Ini adalah unsur paling umum di bumi berdasarkan massa, membentuk sebagian besar bagian inti luar dan dalam bumi.
b. Aluminium
Aluminium ialah unsur kimia. Lambang aluminium ialah Al, dan nomor atomnya 13. Aluminium ialah logam paling berlimpah. Aluminium bukan merupakan jenis logam berat, tetapi merupakan elemen yang berjumlah sekitar 8% dari permukaan bumi dan paling berlimpah ketiga.
3. Dasar Teori[Kembali]
23.5 Ikatan dalam Senyawa Koordinasi: TeoriMedan Kristal [Kembali]
Teori ikatan dalam senyawa koordinasi harus memperhitungkan sifat-sifat seperti warna, magnet, stereokimia dan kekuatan ikatan. Karena belum ada teori yang menjelaskan itu
semua, digunakan beberapa pendekatan yang telah diterapkan pada logam transisi kompleks. Salah
satunya adalah teori medan kristal yang menyumbang warna dan sifat magnetik dari banyak senyawa koordinasi.
Pemisahan medan kristal dalam teori oltahedral kompleks
Teori medan kristal menjelaskan ikatan dalam ion kompleks murni dalam kekuatan
elektrostatik. Dalam ion yang kompleks, terjadi dua jenis interaksi elektrostatik. Salah satunya adalah
daya tarik antara ion logam positif dan ligan negatif atau ujung ligan dengan kutub negatif. Ini adalah kekuatan yang mengikat ligan ke logam. Jenis
interaksi kedua adalah tolakan elektrostatik antara pasangan tunggal di ligan
dan elektron di d orbital logam.
Orbital d memiliki orientasi yang berbeda, tetapi saat tidak ada gangguan
eksternal mereka memiliki energi yang sama. Di kompleks oktahedral, atom logam
sentral dikelilingi oleh enam pasang elektron tunggal (pada enam ligan),
sehingga kelima d orbit mengalami tolakan elektrostatik. Besarnya tolakan ini
tergantung pada orientasi d orbital yang terlibat.
Gambar 23.16 lobus titik orbit menuju sudut oktahedron di sepanjang sumbu x dan y, di mana elektron pasangan tunggal
berada
Sebagai hasil dari interaksi logam logan, lima orbital
d dalam kompleks oktahedral dibagi antara dua set
tingkat energi: tingkat yang lebih tinggi dengan dua orbit (dx2 2y2 dan dz 2)
memiliki energi yang sama dan tingkat yang lebih rendah dengan tiga orbit
energi yang sama (dxy, dyz, dan dxz), seperti yang ditunjukkan pada Gambar
23.17 dibawah ini
Pemisahan medan kristal (![]() ) adalah perbedaan energi antara dua set orbital
d dalam atom logam ketika ligan hadir. Besarnya
) adalah perbedaan energi antara dua set orbital
d dalam atom logam ketika ligan hadir. Besarnya ![]() tergantung pada logam dan sifat
ligan yang
berefek langsung pada warna dan sifat magnetik ion
kompleks.
tergantung pada logam dan sifat
ligan yang
berefek langsung pada warna dan sifat magnetik ion
kompleks.
Warna
Gambar 23.18
Roda warna dengan panjang gelombangnya
Teori cahaya yang
dipantulkan juga berlaku untuk cahaya yang ditransmisikan (artinya, cahaya yang
melewati media, misalnya solusi). Perhatikan
saat ion cupric yang terhidrasi, [Cu(H2O)6] 2+, menyerap cahaya di wilayah orange spektrum sehingga
larutan CuSO4 tampak biru saat dilihat.
Cara terbaik untuk
mengukur pemisahan medan kristal adalah dengan menggunakan
spektroskopi untuk menentukan panjang gelombang di mana cahaya diserap. Ion
[Ti(H2O)6]3+ adalah contoh yang mudah,
karena Ti3+ hanya memiliki satu elektron 3d [Gambar 23.19(a)]. [Ti(H2O)6]3+ menyerap cahaya di wilayah spektrum yang terlihat gambar 23.20 dan panjang gelombang yang sesuai dengan
penyerapan maksimum adalah 498 nm [Gambar 23,19(b)].
Gambar 23.20
Panjang gelombang yang sesuai dengan
penyerapan maksimum adalah 498 nm [Gambar 23,19(b)]. Sehingga
untuk menghitung pemisahan medan kristal dapat ditulis dengan rumus:
Dengan
c sebagai kecepatan cahaya dan ![]() sebagai panjang gelombang, sehingga :
sebagai panjang gelombang, sehingga :
Para ahli kimia menghitung
pemisahan kristal untuk setiap ligan dan menetapkan seri spektrokimia, yang merupakan
daftar ligan yang diatur dalam meningkatkan urutan kemampuan mereka untuk
membagi tingkat energi d orbital:
Sifat Magnetik
Besarnya pemisahan
medan kristal juga menentukan sifat magnetik dari ion kompleks. Perhatikan
kompleks oktahedral [FeF6]3- dan [Fe(CN)6]3- (Gambar 23,21). Konfigurasi elektron Fe3+ adalah [Ar]3d5 , dan ada dua cara yang mungkin untuk
mendistribusikan lima elektron di antara orbit d. Menurut aturan Hund, stabilitas maksimum tercapai ketika elektron ditempatkan dalam lima
orbit terpisah dengan putaran paralel dengan kelima elektron memasuki orbit dxy, dyz, dan dxz.
Gambar 23.21 Diagram tingkat energi untuk ion Fe3+ dan untuk [FeF6]3- dan ion [Fe(CN)6]3- kompleks.
Gambar 23.22
menunjukkan distribusi elektron di antara orbit d yang menghasilkan kompleks
spin rendah dan tinggi. Pengaturan aktual elektron ditentukan oleh jumlah
stabilitas yang diperoleh dengan memiliki putaran paralel maksimum versus
energi yang diperlukan untuk mempromosikan elektron ke orbit d yang lebih
tinggi. Karena F2 adalah ligan medan lemah, elektron lima d memasuki lima orbit
d terpisah dengan putaran paralel untuk membuat kompleks spin tinggi. Di sisi
lain, ion sianida adalah ligan lapangan yang kuat, sehingga secara energi lebih
disukai bagi kelima elektron untuk berada di orbital bawah dan oleh karena itu, kompleks spin rendah terbentuk. Kompleks spin tinggi lebih paramagnetik
daripada kompleks spin rendah. Jumlah aktual elektron yang tidak bertanda (atau
berputar) dalam ion kompleks dapat ditemukan dengan pengukuran magnetik, dan
secara umum, temuan eksperimental mendukung prediksi teori medan
kristal.
Gambar 23.22
Tetrahedral dan Planar segiempat kompleks
Pola pemisahan ion
tetrahedral hanya kebalikan dari oktahedral kompleks. Dalam hal ini, orbit dxy, dyz, dan dxz lebih diarahkan pada ligan dan
karena memiliki lebih banyak energi daripada orbit dx2 2y2 dan dz 2 (Gambar
23.23). Sebagian besar tetrahedral kompleks adalah kompleks spin tinggi sehingga pengaturan tetrahedral mengurangi besarnya interaksi logam-ligan,
menghasilkan nilai D yang lebih kecil dibandingkan oktahedral.
Gambar 23.23
Gambar 23.24, pola pemisahan untuk kompleks planar persegi adalah yang
paling rumit dari ketiga kasus diatas. Karena ada lebih dari
dua tingkat energi, kita tidak dapat mendefinisikan pemisahan medan kristal seperti pada kompleks oktahedral dan tetrahedral.
23.6 Reaksi Senyawa Koordinasi[Kembali]
Ion kompleks mengalami reaksi substitusi ligan dalam larutan. Tingkat reaksi ini sangat bervariasi, tergantung pada
sifat ion logam dan ligan.
Dalam mempelajari reaksi peritukaran ligan,
untuk membedakan antara stabilitas ion yang kompleks dan
kecenderungannya untuk bereaksi disebut kinetik labelitas. Stabilitas dalam konteks ini adalah komponen termodinamika, yang diukur dalam pembentukan spesies konstan Kf.
Sebagai contoh, ion kompleks tetracyanonickelate(II) stabil karena memiliki konstanta formasi yang besar,
yaitu Kf = 1 x 1030.
Tanda bintang menunjukkan atom 14C
Koordinasi seperti ion tetracyanonickelate (II) disebut labile
complexes karena mengalami reaksi pertukaran ligan
yang cepat. Dengan demikian, spesies yang stabil secara termodinamik yaitu, yang memiliki konstanta formasi besar belum tentu tidak aktif.
Kompleks yang secara
termodinamik tidak stabil dalam larutan asam adalah [Co(NH3)6]3+. Konstanta keseimbangan untuk reaksi berikut adalah sekitar 1 x 1020.
Ketika keseimbangan
tercapai, konsentrasi [Co(NH3)6]3+ sangat rendah. Reaksi ini merupakan contoh koordinasi inert, ion kompleks yang mengalami reaksi pertukaran yang sangat lambat
(pada urutan jam atau bahkan hari). Hal ini menunjukkan bahwa
spesies termodinamik yang tidak stabil belum tentu reaktif secara kimia. Kebanyakan Ion kompleks
yang mengandung Co3+, Cr3+, dan Pt2+ merupakan inert.
23.7
Aplikasi senyawa koordinasi[Kembali]
a. Metalurgi
Ekstraksi perak dan emas dengan pembentukan kompleks sianida dan pemurnian nikel dengan mengubah logam ke senyawa gas Ni(CO)4 adalah contoh khas penggunaan senyawa koordinasi dalam proses metalurgi.
b. Terapi Khelasi
Digunakan dalam pengobatan Untuk menghilangkan logam berat dalam tubuh. Terapi ini memiliki efek samping yang sangat berisiko bagi tubuh sehingga harus dilakukan dalam pengawasan medis yang ketat.
c. Analisis Kimia
Dimethylglyoxime membentuk padatan berwarna merah bata yang tidak bisa larut dalam Ni2+ dan padatan berwarna kuning yang tidak bisa larut pada Pd2+. Warna-warna yang khas ini digunakan dalam analisis kualitatif untuk mengidentifikasi nikel dan palladium.
Gambar 23.25 struktur nikel dimethylglyoxim yang strukturnya distabilkan oleh ikatan hidrogen
d. Deterjen
Natrium tripolyphosphate merevolusi industri deterjen. Namun, karena fosfat adalah nutrisi tanaman, limbah air yang mengandung fosfat dibuang ke sungai dan danau menyebabkan ganggang tumbuh, mengakibatkan penipisan oksigen. Akibatnya, banyak negara telah melarang deterjen fosfat sejak 1970-an, dan produsen telah mereformulasi produk mereka untuk menghilangkan fosfat.
a. Prosedur Percobaan
1. Buka software Proteus
2. Siapkan komponen komponen yang digunakan seperti sensor thermistor NTC, resistor, relay, LED, baterai, transistor npn.
3. Rangkai komponen komponen tersebut seperti gambar di bawah
4. jalankan/simulasikan rangkaian
b. Rangkaian Simulasi
Prinsip Kerja:
Cara kerja thermistor adalah sesuai dengan namanya, yaitu nilai hambatannya akan berubah karena pengaruh panas pada tubuhnya. Perubahan pada NTC berbanding terbalik. Pada jenis Thermistor NTC, nilai hambatannya akan turun jika suhu pada tubuhnya naik. Misalkan suhu normal adalah 23 derajat Celcius. Pertama, atur suhu sama dengan atau dibawah 23 derajat celcius, maka LED hijau akan menyala. Kedua, atur suhu diatas 23 derajat celcius, maka LED merah yang akan menyala.
c. Video
d. Download









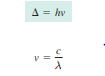










Tidak ada komentar:
Posting Komentar